人群中房颤 (AF) 和慢性肾脏病 (CKD) 越来越普遍。两者有着一些如高龄、高血压和糖尿病等共同的危险因素。这两者相互作用,CKD 患者的增多增加了 AF 的发病率;同时,AF 增加了 CKD 的发病率和/或肾功能的进展性下降。此二者均增加血栓形成风险,在晚期 CKD 患者中,则同时存在出血风险。那么,如何平衡 CKD 患者的血栓与出血风险,如何更好地使用抗聚药物?来自塞尔维亚贝尔格莱德大学的 Tatjana S. Potpara 在最近一期的 Nature Review Nephrology 杂志上进行了综述。
要点 Key Points
•房颤 (AF) 和慢性肾脏病 (CKD),二者有着一些如高龄、高血压和糖尿病等共同的危险因素;
•CKD 患者增加 AF 发生风险,AF 增加 CKD 的发生与进展风险;
•AF 和 CKD 均增加血栓性事件风险;严重的 CKD 患者同时存在出血风险;
•在对比华法林 和非维生素 K 拮抗的口服抗凝药物 (NOACs) 的临床试验中,NOACs 的相对疗效与安全性在无论是否存在中轻度肾功能下降的患者中差别不显著;
•终末期肾脏病患者 (ESRD) 未被纳入 NOAC 的临床研究当中;这部分患者同时存在高血栓形成和出血风险,然而目前没有高级别的证据指导这部分患者抗凝药物的临床应用;
•在 ESRD 患者中,维生素 K 拮抗剂的使用同时存在不同程度的出血和血栓形成风险;然而,合适的维生素 K 拮抗剂抗凝可能降低缺血性中风风险,而不增加出血风险。
口服抗凝剂 (OAC) 治疗包括维生素 K 拮抗剂 (VKAs,最常见是华法林) 和非维生素 K 口服抗凝剂 (NOACs,如达比加群、利伐沙班、阿哌沙班和依达沙班) 。OAC 在房颤合并额外中风危险因素的患者中是预防中风里程碑式的药物。一般来说,CKD 患者的缺血性和出血性事件风险均增加,包括出血性中风、颅内出血、脑微出血和消化道出血。
随着 CKD 的严重程度增长,出血风险升高。AF 患者 OACs 预防中风的 III 临床试验中常常排除了肾功能严重下降的患者。由于缺乏临床试验数据支持,CKD 患者中使用 OACs 是一个令人困扰的问题。那么,CKD 和 AF 的患者,为什么会出现既有促出血状态,又有促血栓状态呢?
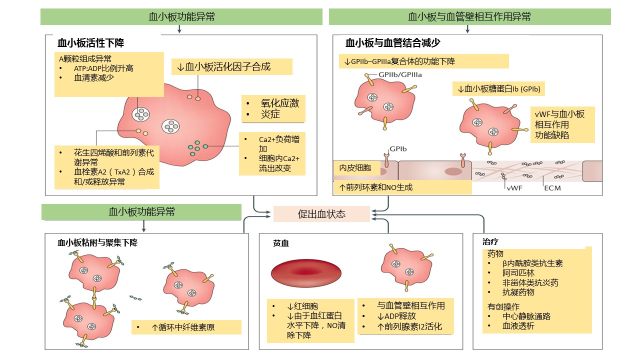
图 1 CKD 患者中促出血状态的病理生理机制
肾功能衰竭常伴有凝血瀑布障碍、纤溶系统亢进、血小板功能下降和血管壁血小板相互作用功能受损等特征。这种状态在 CKD 相关性贫血时更为明显,导致 ADP 释放减少和/或前列腺素 I2(PGI2)的失活,一氧化氮 (NO) 失活减少。CKD 患者中增加出血风险的外在因素包括使用β内酰胺类抗生素(干扰 ADP 受体)、在某些情况下需要服用阿司匹林或非甾体类抗炎药、治疗性有创操作(动静脉内瘘或手术)。
Α颗粒组成异常(包含血小板因子 4、转化生长因子β1、血小板诱导生长因子、纤维链接蛋白、β-血小板球蛋白、血管性血友病因子(vWF)、纤维蛋白原、血清素、凝血因子 V 和凝血因子 XIII)、Ca2+负荷增加和细胞内 Ca2+流出改变导致花生四烯酸和前列素代谢异常、血栓素 A2(TXA2)合成和/或释放异常、抑制血小板活化因子(PAF)合成、氧化应激与炎症,均最终导致血小板活性降低。
血小板与血管壁的结合降低是由于血小板糖蛋白 Ib (GPIb) 受体的蛋白水解增加、GPIIb–GPIIIa 复合体的功能下降、vWF 血小板相互作用功能缺陷、血中前列环素升高、NO 生成增多、NO 代谢产物增加。ECM: 细胞外基质
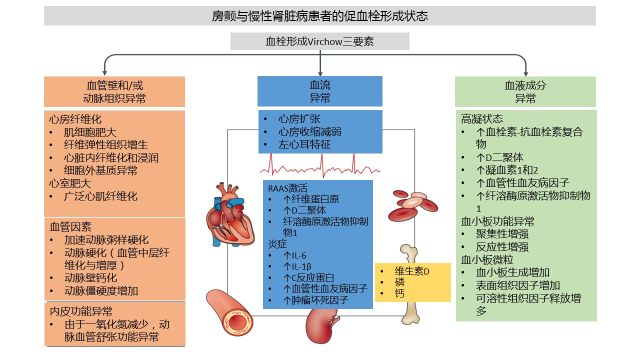
图 2 合并 AF 的 CKD 患者促血栓形成状态的病理生理机制
CKD 和 AF 均与血栓形成风险升高相关。两者均含有血栓形成 Virchow 三要素:血流异常、血液成分异常和血管壁异常。AF 和 CKD 均影响心脏的结构和功能(例如心房纤维化和/或心房扩大、左心室肥大)、血管(例如加快动脉粥样硬化、动脉硬化、动脉壁钙化、动脉壁僵硬度增加等)、血液成分(高凝状态、血小板功能异常)。
保持内皮功能状态平衡的关键因素包括调节凝血瀑布的因子 [如纤溶酶原激活物抑制物(PAI1)、血管性血友病因子(vWF)]、血管紧张度、氧化应激、炎症反应、内皮微小颗粒的生成、内皮祖细胞的分化与修复。
CKD 患者中,血浆同型半胱氨酸升高,可能是肾功能下降与内皮细胞损伤的介导因素。同型半胱氨酸能抑制血栓调节蛋白依赖的蛋白 C 活化系统,导致凝血酶活化、纤维素蛋白形成、组织型纤溶酶原激活物的释放减少,从而纤溶减少,增加血栓形成风险。血浆中高浓度的纤维蛋白原、D 二聚体、血栓素-抗血栓素复合物、凝血因子 VII、血管性血友病因子、血栓调节素和 PAI1 是尿毒症患者内皮细胞受损的标志。
血小板功能受损也导致合并 AF 的 CKD 患者的高凝状态。以 microRNA 为基础的 mRNA 调剂机制的改变可能也影响血小板对尿毒症的反应,导致血小板相关并发症。血小板微粒浓度升高同时也增加合并 AF 的 CKD 患者的高凝状态。血小板微粒是在炎症、细胞分化与衰老是,由内皮细胞的浆膜、血小板、单核细胞和巨噬细胞等形成。其表达磷脂酰丝氨酸(协助凝血素转化为血栓素)、膜结合组织因子和可溶性组织因子,从而促进凝血和血栓形成。
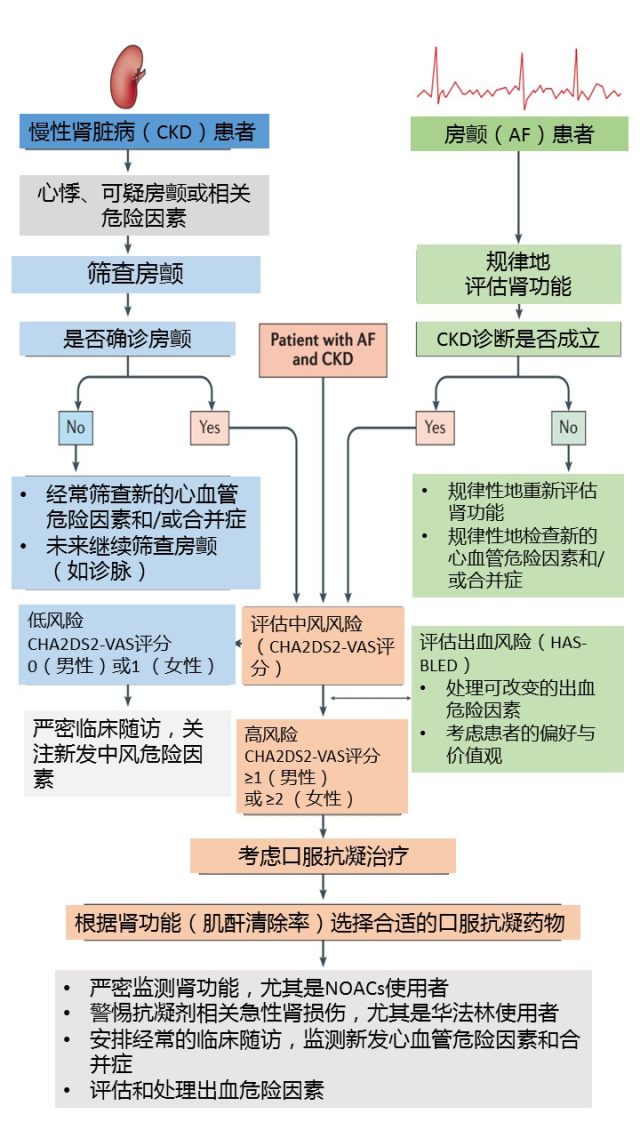
图 3 合并 AF 的 CKD 患者中,抗凝药物使用流程
合并 AF 的 CKD 患者中是否使用 OAC,需要根据中风与出血风险的评估。对于中风高危患者,根据临床实践指南,参考 Cockcroft–Gault 公式计算肌酐清除率,选择合适的抗凝药物 [维生素 K 拮抗剂或非维生素 K 口服抗凝剂(NOAC)] 和剂量。随访中需要经常重新评估肾功能、心血管和出血危险因素、合并症等。
