最近看到一则病例,增强 MRI 显示右侧额叶环形强化伴有水肿和占位效应,怀疑肿瘤,行右侧额叶切除,但其实......
患者 61 岁,近期出现步态异常、尿失禁和嗜睡,伴有脂肪肝。既往有牛皮癣、双眼白内障。其兄弟和父亲都曾有不明原因的颅内占位。
父亲、兄弟都死了
患者父亲的资料已无法追寻,只能从患者的口述中得知:其父亲在 50 多岁时发现可疑脑部肿物,活检显示血管炎性改变。接受强的松治疗,但在症状出现 5 年后死亡。
患者兄弟的资料
患者的兄弟 58 岁时出现进行性步态障碍和认知能力下降,2 个月后急性发作全身性癫痫和精神错乱。
既往病史:双侧白内障和病因不明的肝病 10 年,并通过多次肝脏活检检查。
神经系统查体:记忆障碍,左侧面瘫和四肢轻瘫。
眼科检查显示双侧视盘苍白。实验室检查发现血小板减少,贫血和转氨酶增高。
头颅 CT 显示右侧额叶低密度和散发点状钙化(A 和 B)。进一步 MRI 检查显示右侧额叶环形强化病灶,伴多发室周病灶(C 和 D)。
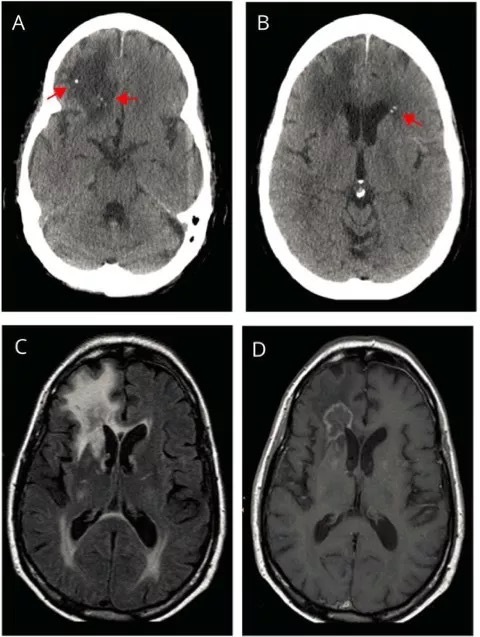
活检发现反应性神经胶质增生伴坏死和细胞增多。CSF 未见明显异常。
诊断为瘤样多发性硬化,给予激素冲击、血浆置换、那他珠单抗治疗后,症状缓解,几年后却又出现新的病灶(E 和 F)。认知与步态异常症状波动进展,4 年后死亡。
不幸再次降临这家人,他会怎么样?
完善相应检查,疑似肿瘤
患者入院后进行了相关的检查。查体发现失抑制和左侧偏瘫。实验室检查显示贫血、血小板减少和转氨酶升高。
头颅 CT 显示右侧额叶低密度和非特异性钙化(A-C),增强 MRI 显示右侧额叶环形强化伴有水肿和占位效应(D-F)。
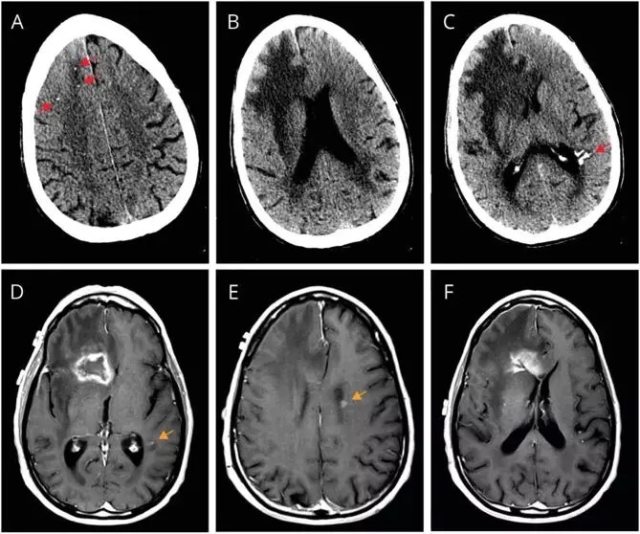
因怀疑肿瘤,给于右侧额叶切除。
真相揭晓
病理显示反应性胶质细胞增多,局灶性坏死和钙化,血管周围淋巴细胞增多。无感染和肿瘤的证据。启动大剂量激素治疗,患者偏瘫症状好转。
患者的基因检测显示 TREX1 基因突变(c.703dupG[V235 Gfs]),最终诊断为:视网膜血管病伴脑白质病(RVCL)。
RVCL
RVCL 是由 TREX1 基因突变引起,属于单基因遗传性脑小血管病的一种。RVCL 是成人发病的常染色体显性遗传性疾病。发病年龄 30~50 岁。
它包括大脑视网膜血管病(CRV),遗传性血管视网膜病(HVR)和遗传性内皮细胞病伴视网膜病变、肾病和卒中(HERNS)3 种情况。
HERNS
HERNS 主要表现为 45 岁以后出现视野缺损,反复卒中发作,肾功能不全和蛋白尿,常伴有不同程度的精神症状。早期表现为视觉损害和肾功能障碍。
神经系统症状一般出现在 30~50 岁,呈偏头痛样头痛、并逐渐出现局灶性神经功能损害(如偏瘫、构音障碍、失用等)。
HVR
HVR 患者早期表现为集中在黄斑周围的视网膜微血管病变:微动脉瘤和毛细血管扩张。晚期视网膜动脉分支闭塞。
80% 患者存在雷诺现象,70% 患者具有偏头痛,55% 患者雷诺现象和偏头痛二者同时存在。
CRV
CRV 患者临床表现为视网膜毛细血管变性和脑血管病变。神经系统表现为偏头痛、卒中和痴呆。脑 MRI 显示「假瘤征象」,并且脑内假瘤发生在 50 岁之前,为其主要致死原因。
CRV 与 HERNS 患者多于 55 岁内死于神经系统并发症。
RVCL 的影像特点
RVCL 的影像特点能够为诊断提供线索,额叶脑室周围斑片状白质病变以及边缘增强病变,病变长时间的弥散限制和持久的增强。此病需要与瘤样脱髓鞘,恶性胶质瘤,CADASIL 等单基因脑血管病鉴别诊断。识别此疾病能够避免无必要的脑部活检。
能做些什么?
目前尚无有效的治疗方法,治疗原则主要是减轻疼痛及缓解症状。对于部分患者可给予激光治疗以预防肾脏出血,小剂量泼尼松维持治疗可以减轻脑水肿。
RVCL 预后较差,生存期 5-10 年。
临床应对该病予以关注,以防误诊。分享这一病例的目的就是提醒大家,不是所有的水肿和环形强化都是肿瘤,不要造成更多的伤害。
参考文献:
1. 余英欣, 姚生, 戚晓昆, 等. 伴有视网膜病-肾病-卒中的遗传性内皮细胞病一例. 中国神经免疫学和神经病学杂志. 2018, 25(6): 452-455.
2. 李伟, 张在强. 单基因遗传性脑小血管病. 中国卒中杂志. 2009, 4(5): 400-407.
3. Raynowska J, Miskin DP, Pramanik B, et al. Retinal vasculopathy with cerebral leukoencephalopathy (RVCL): A rare mimic of tumefactive MS. Neurology. 2018 Oct 9;91(15):e1423-e1428.
4. Blalock A, Harvey AM, Ford FR, Lilienthal JL. The treatment of myasthenia gravis by removal of the thymus gland. JAMA 1941; 117: 1529-33.
5. G.I. Wolfe, H.J. Kaminski, I.B. Aban,et al. Randomized Trial of Thymectomy in Myasthenia Gravis. N Engl J Med 2016;375:511-22.
6. Jaretzki A III, Barohn RJ, Ernstoff RM, et al. Myasthenia gravis: recommendations for clinical research standards. Neurology 2000; 55: 16-23.
