电解质紊乱是散布于各个科室的常见病,临床上医生几乎每天都在与其打交道,但这门「必修课」并非想象中那么简单,就比如下面这个病例的 3 个提问,你是否都能答上来?
患者因「嗜睡、定向力障碍」就诊,入院后查血钠 106mEq/L,问:此时诊断考虑什么?
该患者 48 小时内血钠水平被快速纠正至 129mEq/L,并伴有症状的明显改善。问:低钠血症该如何纠正?需要注意什么?
第 4 天患者神经系统症状突然恶化,处于昏迷状态,查体示锥体束征,问:此时需要考虑什么问题?
1. 低血钠性脑病
(1)病理生理:
在低血钠状态下,血液渗透压明显下降,使循环和中枢神经系统之间产生渗透梯度,血液中的自由水顺渗透梯度通过细胞表面的水通道蛋白进入脑内引起细胞水肿。
正常情况下,细胞水肿所致的脑实质容积增加可被机体代偿机制所抵消:
细胞水肿导致组织间隙静水压增大,促使水从组织间隙进入脑室系统并经由脑脊液循环分流排泄。
胶质细胞通过将渗透活性物质外排以降低胞内渗透压,循环-脑组织渗透梯度的减少阻止了脑水肿的进一步加剧。其中,细胞内钾离子可快速响应,在数小时内经膜通道离开细胞;而胞内有机溶质,包括牛磺酸、谷氨酰胺、谷氨酸盐、天冬氨酸盐等需待相关膜转运体激活后被排泄至胞外,后者多发生在 24 小时后。
虽然上述适应性调节在一定范围内缓解了脑水肿,但当低血钠程度或形成迅速超过了代偿机制时,脑水肿可进一步加剧导致颅内压增高引发严重的神经损伤。
(3)分类:
根据低血钠形成速率及持续的时间,可将低钠血症分为急性和慢性期:
急性低钠血症(持续时间<48 h):
一般而言,急性低血钠患者的临床症状取决于脑水肿的严重程度。
血钠水平低至 125 ~130 mEq/L 时,大多数患者可出现恶心呕吐、无力等表现;
当血钠水平进一步降低至 115~120mEq/L 时,患者可表现为头痛、嗜睡,更严重的症状还包括癫痫发作、昏迷以及呼吸暂停等。
尽管临床症状的严重程度与血钠水平成线性相关,低血钠形成的速率是预测神经功能恶化更为重要的指标。
另一方面,细胞水肿导致的颅内压急剧升高,将进一步影响大脑灌注压差,表现为全脑缺血,分水岭区因位于终末血供区更易早期出现梗死病灶。
慢性低钠血症(持续时间>48 h):
慢性低钠血症患者可仅有轻微的非特异性症状,表现为乏力、恶心呕吐、头晕、步态不稳、嗜睡、遗忘等。
更为常见的情况是,由于慢性代偿机制的存在,患者可无任何不适,即使血钠水平长期低于 120 mEq/L。
(3)补钠时最常见的并发症——渗透性脱髓鞘综合症:
多发生于快速输注盐水纠正慢性低钠血症患者,病人多在血钠水平纠正后的 2~5 天出现出现神经功能障碍,包括痉挛性四肢瘫痪、假性延髓麻痹、癫痫发作和昏迷等。
关于渗透性脱髓鞘综合症发生的具体机制尚不明确,目前认为这可能与代谢压力诱导的细胞凋亡以及血脑屏障的破坏有关(图 1)。
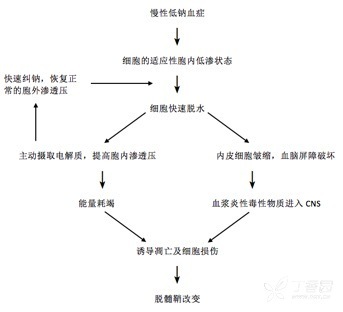
图 1:渗透性脱髓鞘发生的病理生理机制
经典的渗透性脱髓鞘综合症最常见于脑桥,被称为脑桥中央髓鞘溶解(图 2),这可能与脑桥处特殊的解剖结构特点相关。在脑桥内,轴突和神经胶质细胞聚集形成紧密的线性结构,因此在低钠时这些细胞只能丢失更多的离子而不是增大容积来维持细胞稳定性,这样一来,当低钠血症被快速纠正时,脑桥胶质细胞将经受的更大代谢压力更易早期出现髓鞘脱失等表现。
此外,脑桥外髓鞘溶解也并非少见(图 2),可见于丘脑、基底节、中脑、皮层下白质和小脑等多个解剖部位。一般而言,安全的纠钠速率可控制在 24 小时内<8~10 mmol/L 或者 48 小时内<18 mmol/L。
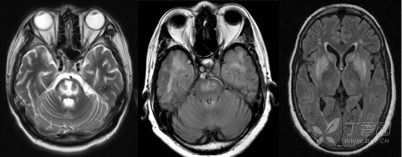
图 2:三例渗透性脱髓鞘综合症的患者的头颅磁共振影像。左:脑桥中央部 T2 信号增高,呈三叉戟样。中:脑桥中央部及双侧前颞叶 T2 信号增高。右:双侧基底节区的 T2 信号增高
(4)特殊情况
由于低血钠症主要影响血液渗透压导致中枢神经系统症状,因此低血钠性脑病实际是低渗性脑病。但是特殊情况情况下,低血钠并非总是伴随低渗状态,因此并不能简单认为:低血钠+神经系统症状/体征 = 低血钠性脑病
假性低钠血症:见于严重高脂血症或者异常高蛋白血症患者,体内钠含量正常,因血液脂质及蛋白成分增多而产生假性的低血钠,此时血液渗透压正常。
严重未控制糖尿病:严重的高血糖将导致血浆渗透压的增高,组织间隙及细胞内游离水将转运入血液导致稀释性低钠血症。此时患者的神经功能变化并非继发于低血钠,而与血液高渗导致的中枢神经细胞脱水相关。
2. 高血钠性脑病
(1)病理生理:
高血钠导致的病理生理过程刚好与低血钠相反,高血钠导致循环渗透压明显上升,细胞内水分将顺渗透梯度转运到细胞外液,并进一步进入血液循环。
类似的适应性机制也被激活以代偿脑组织脱水:
组织间隙静水压降低,促使水从脑脊液循环逆向进入组织间隙。
胶质细胞胞内渗透压的适应性调整早期依赖于对钠、钾离子的重新摄入,而后期膜溶质转运体的合成促进了牛磺酸、谷氨酰胺、谷氨酸盐等有机溶质被转运入胞,以维持适应的渗透压。
同样地,当高血钠程度或形成迅速超过了代偿机制时,细胞脱水将导致严重的中枢神经系统症状。
(2)分类:
急性高钠血症(持续时间<48 h):
因高血钠程度以及形成的速率不同,高钠血症患者的症状表现具有多样性,症状轻微时可仅表现为易激惹、乏力,严重时可导致肢体抽搐、癫痫发作甚至昏迷。
血钠水平的急剧增高将导致细胞快速脱水,而脑组织容积的减小及颅内压的降低则促使血管代偿性扩张。其中,大脑凸面的中小血管,包括大脑凸面皮层动脉、桥静脉更易受到机械牵拉而损伤、破裂出血,导致继发蛛网膜下腔出血、硬膜下血肿、皮层静脉血栓以加剧神经功能恶化。
另外,也有研究报道渗透性脱髓鞘改变出现于血钠急剧升高的高钠血症患者。
慢性高钠血症(持续时间<48 h):
与慢性低钠血症类似,由于代偿机制的存在,患者可无明显临床症状。
由于细胞的适应性调节,慢性高钠血症的神经胶质细胞处于胞内高渗状态,过快的纠正高钠可诱使细胞外液的自由水快速入胞导致细胞水肿,加剧神经功能恶化。
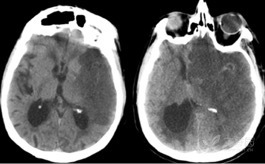
图 3: 一例大面积脑梗死伴高血钠症患者在快速纠正血钠水平后出现神经症状恶化,复查头颅 CT 提示梗死区水肿明显扩大并伴有中线偏移
3. 其他电解质紊乱所致的神经系统症状
(1)低血钾:
与钠离子相对,人体内 98% 的钾离子位于细胞内。因肌肉组织为富钾组织,因此血钾紊乱常以肌肉症状为首发表现。
当血钾水平降低时,肌细胞膜处于超极化状态,肌肉对神经的刺激反应降低,易于导致肌肉麻痹。
当血钾水平在 3.0~3.5 mEq/L 时,患者可仅出现乏力、肌肉酸痛、易疲劳等表现;
当血钾进一步降低至 2.5~3.0mEq/L 时,患者可出现四肢弛缓性瘫痪,以肢体近段无力为主,临床可见于甲亢、低钾周期性麻痹等。
文献报道,少见情况下横纹肌溶解可见于严重低钾血症患者。
(2)低血钙:
由于钙离子可降低神经肌肉的兴奋性,因此血钙水平紊乱导致的症状与神经肌肉的兴奋性变化相关。
低钙血症可见于甲状旁腺功能低下、急性胰腺炎患者,外周神经元过度兴奋低钙血症最重要的病理生理效应,但这种过度兴奋发生于任何水平的神经系统,包括运动终板、脊髓反射和中枢神经系统。
临床症状的轻重与血钙降低的程度不完全一致,而与血钙降低的速度、持续时间有关。症状轻微时,患者可仅表现为口周麻木、肢端感觉异常等,严重时可出现相关受累肌肉痉挛,甚至局灶性或全面性癫痫发作。
受累肌肉痉挛:
手足痉挛可自发出现,或经束臂加压数分钟诱发, 后者被称为 Trousseau 征;
轻扣外耳道前面神经可引起同侧面肌的痉挛收缩,被称为 Chvostek 征;
当受累肌肉累及声门或呼吸肌时,可引发喘鸣、乃至严重的呼吸困难。
癫痫发作:可出现癫痫发作的多种形式,包括全面性强直阵挛发作、失神发作以及局灶性发作等,同步脑电图上可记录到棘波与高电压阵发性慢波的并存。
(3)低血镁:
镁离子缺乏所致的神经系统症状与低血钙相似,同样被认为与神经肌肉的兴奋性增高相关。患者可出现 Trousseau 征、Chvostek 征阳性,以及类似的肌肉痉挛表现。全面性强直阵挛发作或多灶性运动性癫痫发作可见于低血镁患者,少见情况下患者可出现手足徐动或舞蹈样运动。除神经肌肉过度兴奋表现外,患者还可出现情感淡漠、谵妄甚至昏迷等。对于重度低镁血症,垂直性眼球震颤是一种罕见体征,具有诊断价值。
(4)低血磷:
除了对钙、镁代谢产生影响外,低磷血症的临床表现主要是细胞内磷损耗引发的结果,其几乎可以影响所有的器官系统。
低磷血症因细胞内 ATP 的耗竭导致代谢性脑病,症状从轻度的异激惹、感觉异常,到严重时出现全面性癫痫发作、谵妄和昏迷等。
少见情况下,严重磷损耗也可促进中央桥脑和脑桥外的髓鞘溶解症。同样地,低磷血症诱发的肌肉功能障碍表现包括骨骼肌近端肌病、吞咽困难、心肌收缩下降、麻痹性肠梗阻等。
参考文献:
[1] Diringer M. Neurologic manifestations of major electrolyte abnormalities[J]. Handb Clin Neurol, 2017, 141: 705-713.
[2] Riggs J E. Neurologic manifestations of electrolyte disturbances[J]. Neurol Clin, 2002, 20(1): 227-39, vii.
[3] Oya S, Tsutsumi K, Ueki K, et al. Reinduction of hyponatremia to treat central pontine myelinolysis[J]. Neurology, 2001, 57(10): 1931-2.
[4] Juergenson I, Zappini F, Fiaschi A, et al. Teaching neuroimages: neuroradiologic findings in pontine and extrapontine myelinolysis: clue for the pathogenesis?[J]. Neurology, 2012, 78(1): e1-2.
[5] Achinger S G, Ayus J C. Treatment of Hyponatremic Encephalopathy in the Critically Ill[J]. Crit Care Med, 2017, 45(10): 1762-1771.
